El suelo es la capa más superficial de la corteza terrestre (abarca el primer metro de profundidad); en el cual ocurren los cambios (químicos y físicos) y que se pueden identificar a simple vista, tocar o medir y analizar en laboratorio.
Importancia del Suelo
Las diferentes formas en que se emplean el terreno y su cubierta vegetal son muy variados.
El suelo forma parte importante de las actividades del hombre en diversos ámbitos, tales son la agricultura, ganadería, forestal, social y económico por mencionar algunos.
En el se desarrolla la vida vegetal y animal y es fuente nutrimental para estas. Está directamente vinculado con la agricultura y ganadería, debido a que a partir de estas actividades económicas se provee a los seres humanos de alimentos, a través de la obtención de nutrientes del suelo.
La agricultura por su parte, al tratarse de una actividad económica primaria forma parte influyente en la economía de algunos países tanto productores y exportadores; y con esto ayuda al desarrollo de la infraestructura de estos.
Ayuda a la ganadería generando alimento para el pastoreo de los animales.
A partir del tipo de suelo se determinan los diferentes tipos de climas existentes a lo largo del planeta y con esto tipifica el tipo de flora y fauna relacionados en una región especifica.
Sirve como filtro transformados de contaminantes producidos sobre todo por el hombre.
Provee de materiales para la construcción de diversos objetos de uso cotidiano,un ejemplo de esto son los tabiques cuya obtención es gracias a la existencia del suelo arenoso, así como también el material para hacer carreteras, extracción de leña y pastoreo. En forma general podría resumirse en que abastece la demanda de materia prima para la producción de productos secundarios y terciarios.
Se ha destinado una porcion de suelo para la demanda de vivienda, el cual debe tener algunas características específicas para ser habitable y contribuir con el desarrollo urbano y la creación de industrias. En la mayoría de los casos afectando a con esto los ecosistemas y directamente al medio ambiente, debido a que se genera mayor es niveles de contaminación.
Existen también zonas destinadas a las reservas naturales, complejos turísticos áreas naturales y reservas territoriales entre otros, que también suministran a diversos paises de riquezas tanto naturales como de tipo monetario.
El suelo es indispensable para el desarrrollo y abastecimiento de la humanidad, sin el la vida en la Tierra sería muy diferente a lo que es hoy en día.
miércoles, 25 de enero de 2012
lunes, 23 de enero de 2012
Diseño de Práctica para Laboratorio
¿Qué le Sucede a las Sustancias al Quemarlas?
Introducción
Hipótesis
Los compuestos orgánicos a diferencia de los inorgánicos, en su mayoría son flamables. Debido a que los compuestos que fungen como reactivos están constituidos por átomos de carbono, hidrógeno, oxígeno o nitrógeno; lo que permite la presencia de una ruptura de klos enlaces de comburente y combustible y genera co2 y vapor de agua.
Objetivo
Establecer como afecta el calor a sustancias orgánicas e inorgánicas para determinar su clasificación atravez de los productos de su combustión
Preparación
Materiales
Procedimiento
Introducción
La clasificación de los compuestos y el fenómeno de la combustión son los tópicos a desarrollar en esta práctica.
Se busca establecer algunas características de los compuestos orgánicos a partir de los productos de su combustión .
Se destacará a la combustión como una reacción de oxidación que se requiere para obtener energía.
Las actividades están orientadas a identificar los productos generados a partir de la combustión.
Problema
¿Cómo afecta el calor a sustancias comunes?Hipótesis
Los compuestos orgánicos a diferencia de los inorgánicos, en su mayoría son flamables. Debido a que los compuestos que fungen como reactivos están constituidos por átomos de carbono, hidrógeno, oxígeno o nitrógeno; lo que permite la presencia de una ruptura de klos enlaces de comburente y combustible y genera co2 y vapor de agua.
Objetivo
Establecer como afecta el calor a sustancias orgánicas e inorgánicas para determinar su clasificación atravez de los productos de su combustión
Preparación
Materiales
- Soporte universal
- cuatro tubos de ensayo
- Tubo de Conducción
- Dos tapones Horadados
- mechero Bunsen
- Balanza granataria
- Pinzas para tubo
- Cucharillla de Combustión
- Colocar 0.5g de azúcar o de harina en un tubo de ensayo previamente etiquetado
- En el segundo tubo de ensayo agregar 2ml de disolución filtrada de hidróxido de calcio con dos gotas de fenolftaleina.
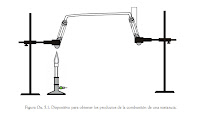
- Montar el dispositivo como se muestra en la figura para recoger los productos de la combustión.
- Calentar la harina, pan o tortilla y el azúcar (0.5g por separado) en un tubo de enesayo como lo muestra la figura anterior. Realizar el calentamiento por un tiempo máximo de cinco minutos.
- Calentar el cloruro de potasio o sodio en una cucharillade combustión por tres minutos.
- Observar cuidadosamente el proceso de combustión y registrar en la tabla de observaciones:
Análisis de resultados
Conclusiones
jueves, 19 de enero de 2012
¿Qué es el suelo?
Suelo
El suelo es la capa más superficial de la corteza terrestre (abarca el primer metro de profundidad), en la cual ocurren cambios (físicos y químicos) que se pueden identificar a simple vista, tocar, medir y analizar en laboratorios.

La Edafología o Pedología es la ciencia de la
Geografía que estudia los suelos.
Geografía que estudia los suelos.
¿Por qué es importante el suelo?
Porque es el sustrato sobre el cual se desarrolla la vida vegetal y animal. Además, el suelo protege el medio ambiente, ya que actúa como filtro y transformador de contaminantes producidos sobre todo por el hombre.
Por su uso, puede clasificarse como:
- agrícola
- forestal
- industrial
- habitacional
| Existen diferentes tipos de suelo y conocer sus características es importante para aprovecharlos de la mejor manera; por ejemplo, para ubicar los suelos útiles en la agricultura y, dependiendo de sus características, identificar cuál es la mejor manera de enriquecerlos con fertilizantes y qué cantidad de agua de riego necesitan para la producción de cultivos, por ejemplo es muy diferente regar un suelo arenoso que uno arcilloso que tiende a inundarse. |  |
| Dependiendo de sus características, podríamos localizar suelos arenosos (cuyas partículas sirven para elaborar chips de computadoras o tabiques para construir viviendas) o suelos gravosos y pedregosos que proveen al ser humano de material para hacer carreteras, entre otras cosas. |  Cuatro Ciénegas, Coahuila, México. |
¿De qué está hecho el suelo?
El suelo tiene cuatro componentes:
Compuestos inorgánicos, como: grava, arcilla, limo y arena. | |
| Nutrientes solubles, importantes para las plantas: nitrógeno, fósforo, potasio, calcio y magnesio. | |
| Materia orgánica de organismos muertos, como: lombrices, hongos, bacterias y restos de plantas en cualquier proceso de descomposición. | |
| Agua y gases, por ejemplo hidrógeno y oxígeno, que ocupan los espacios porosos libres. |
Las proporciones de cada uno de ellos son variables: en zonas de clima templado-húmedo, la materia orgánica representa entre 2 y 5 por ciento; en cambio, en el desierto puede ser menor de 1 por ciento. En climas secos, por lo general, los suelos son más arenosos y con mayor presencia de calcio y sodio; por el contrario, en los húmedos tienden a ser más arcillosos en general y con mayor concentración de elementos ácidos, como fierro y aluminio.
¿Cómo se clasifican los suelos?
Se clasifican por su origen geológico y forma, a través de un estudio que se llama perfil de suelo. Para realizarlo es necesario:
 | 1.- Elegir una zona que tenga clima, rocas y tipo de vegetación representativo. 2.- Buscar la mejor ubicación de la zona elegida (iluminación, inclinación del terreno y lejos de zonas muy alteradas por el hombre). |
3.- Excavar hasta llegar a 125 cm de profundidad o hasta topar con roca o agua. 4.- Separar las diferentes capas u horizontes de perfil, que en general son cuatro. |  |
| 5.- Analizar sus características físicas (profundidad, textura y color) y químicas (Ph, manchas de oxidación, salinidad y contenido de carbono orgánico). |  |
 | 6.- Tomar muestras (1.5 kg) de cada capa para enviarlas a laboratorio, donde se determinan los elementos que los constituyen y en qué proporción. |
viernes, 13 de enero de 2012
Diseño de Práctica para Laboratorio
"La Combustión como una Fuente de Energía"
Introducción
La combustión corresponde a una reacción química, en la cual un elemento combustible se combina con un comburente (O2) desprendiendo calor, es decir, se trata de una reacción exotérmica y en ella se producen sustancias como bióxido de carbono y vapor de agua.
Problema
¿Qué tipo de sustancias se requieren para obtener energía?
Hipòtesis
La combustión es una reacción de oxidación que se requiere para obtener energía.
Objetivo
Hacer énfasis en la reacción de combustión como fuente generadora de energía y contaminantes.
Introducción
La combustión corresponde a una reacción química, en la cual un elemento combustible se combina con un comburente (O2) desprendiendo calor, es decir, se trata de una reacción exotérmica y en ella se producen sustancias como bióxido de carbono y vapor de agua.
Problema
¿Qué tipo de sustancias se requieren para obtener energía?
Hipòtesis
La combustión es una reacción de oxidación que se requiere para obtener energía.
Objetivo
Hacer énfasis en la reacción de combustión como fuente generadora de energía y contaminantes.
Materiales
- Una vela de 20 cm de altura
- Cerillos
- Un plato de cerámica o plástico
- Un vaso precipitados de 250 ml
- Pinzas para vaso
- Un embudo de vidrio de talle corto
- Tubo de ensayo chico con tapon
- Papel aluminio
- Un trozo de hielo
- Sal
- Agua de Cal
Procedimiento
- Fija la vela en el centro del plato, enciéndela y observa la flama que se produce. Enseguida, coloca, por unos segundos, un vaso de precipitados sobre la flama empleando unas pinzas para tu seguridad.
- Envuelve en papel aluminio unos trozos de hielo rociados de4 sal, sujétalos con la mano formando una especie de bolsa y colócala sobre la vela encendida a unos 15cm de la flama.
- Coloca un embudo de filtración de talle corto, de vidrio, en forma invertida sobre la flama, acerca un cerillo encendido a la punta del talle y anota tus observaciones. Ahora coloca un tubo de ensayo chico sobre el talle del embudo, también en forma invertida y colecta el gas que procede de la flama a través del mismo embudo.
- Después de unos segundos tapa el tubo que contiene el gas colectado y agrégale 1 mililitro de una disolución incolora de cal previamente preparada y agita vigorosamente el contenido.
Análisis de Resultados
Conclusiones
Química1
Agua y Oxígeno
Antonio Rico Galicia
Rosa Elba Pérez Orta
María José Castellanos Zoreda
¿Qué les sucede a las sustancias al quemarlas?
investigación documental
REACCIÓN DE OXIDACIÓN
El oxígeno es un elemento muy activo, que forma directamente compuestos con todos los elementos, a excepción de algunos de los llamados gases nobles. Se llaman óxidos a los compuestos simples que forma el oxigeno con otros elementos. La reacción química en la que el oxígeno se combina con otro elemento para formar óxidos se llama oxidacion.
la formacion de óxido de calcio y de agua constituyen dos ejemplos de oxidacion:
2Ca(s)+O2(g)=2caO(s)
2H2(g)+O2(g)=2H2O(g)
El agua es realmente un óxido de hidrógeno, aunque generalmente no lo expresemos así.
Un ejemplo de oxidación es la lenta formación de orín (óxido de hierro (III) hidratado), cuando el hierro se deja expuesto mucho tiempo a la acción del oxigeno. en presencia de humedad:
4fe(s)+3O2(g)+6H2O(g)=2Fe2O3 * 3H2O(s)
Si una varilla de hierro se calienta hasta la incandescencia y se introduce en una botella llena de oxígeno, la reacción de oxidación es tan vigorosa que el hierro arde brillantemente, arrojando chispas de óxido de hierro magnetico:
3Fe(s)+2O2(g)=Fe3O4(s)
Ordinariamente, las reacciones de oxidación van acompañadas de liberacion de calor. En oxidaciones lentas, como el enmohecimiento del hierro o la putrefacción de la madera, no es fácil descubrir el calor desprendido, por liberarse lentamente.
Sin embargo, mediante mediciones cuidadosas, se ha demostrado que la energía total liberada es la misma, ya sea que la sustancia se oxide lenta o rápidamente. Esto es, otra comprobación experimental de la Ley de la conservacion de la energía.
Si una sustancia reacciona rápidamente con el oxígeno, con desprendimiento apreciable de calor y luz, se dice que la sustancia esta ardiendo. (El término combustión se refiere a cualquier reacción química que produce luz y calor; arder es sólo un tipo de combustión).
LA PRODUCCIÓN DE ENERGÍA POR OXIDACIÓN DE COMBUSTIBLES PROVENIENTES DEL PETRÓLEO, REACCIONES QUÍMICAS QUE SE LLEVAN A CABO Y PRODUCTOS DE LA COMBUSTIÓN
Existen diferencias entre los compuestos orgánicos e inorgánicos; los orgánicos representativos son inflamables, algunos de ellos en muy alto grado; por ejemplo, la gasolina. mientras que los compuestos inorgánicos no son inflamables.
Cuando una sustancia se quema y produce energía está llevando a cabo una reacción de combustión. Entenderemos por combustión a la combinación entre una sustancia con el oxígeno para producir energía; este tipo de reacción química se le considera una oxidación rápida, la sustancia que se quema es el combustible y el oxígeno, en este caso, es el comburente (favorece la combustión).
Los combustibles son sustancias de origen orgánico que contienen almacenada en sus enlaces químicos (covalentes) una gran cantidad de energía; implican reacciones químicas con el oxígeno del aire a temperaturas muy elevadas. Por ejemplo, cuando el metano (CH4), principal componente del gas natural, se quema frente al oxígeno produce CO2, vapor de agua y liberación de la energía almacenada en forma de luz y calor, proceso en el cual se cumple la Ley de la Conservación de la materia y la energía. Las más comunes son las de los compuestos formados por carbono e hidrógeno entre las que destacan el petróleo y el gas natural, que son algunas de las principales fuentes de energía que nuestra sociedad requiere.
El Sol es la principal fuente de energía de nuestro planeta y es a través de la fotosíntesis que la energía radiante se almacena como energía química en las plantas. Por lo anterior, la energía solar constituye la fuente básica de energía para nuestro planeta. Parte de esta energía se almacena en combustibles como la madera el carbón y el petróleo.
La mayoría de los combustibles comunes están constituidos de átomos de carbono e hidrógeno. Cuando estos materiales materiales arden al aire libre los productos principales de la combustión son el dióxido de carbono(en una situación de aire restringido se produce el monóxido de carbono CO, en lugar de dióxido de carbono CO2) y el vapor de agua, pero lo verdaderamente importante es la cantidad de calor que se desprende durante el proceso.
Si estableciéramos el modelo molecular de una reacción de combustión, lo que se presenta es la ruptura de los enlaces del combustible y del oxígeno, y la formación de nuevos enlaces para el dióxido de carbono y vapor de agua. Cabe entender que para romper un enlace se necesita aplicar energía y para formarlo se libera energía.
IMPUREZAS DE LOS COMBUSTIBLES Y PRODUCTOS QUE SE FORMAN
El uso de los combustibles derivados del petróleo y el gas natural se inició a principios del siglo XX, con el descubrimiento de grandes yacimientos y la consecuente aparición de empresas petroleras que las explotaron. En la actualidad, son los principales combustibles y se ocupan también para producir otras forma de energía, como la eléctrica. Pero estos recursos no son infinitos, por lo que la búsqueda de alternativas para obtener energías es hoy un problema fundamental.
Hay reacciones químicas que producen gases que son emitidos hacia la atmósfera. En los últimos años, ha crecido la preocupación acerca del efecto que esas reacciones tienen sobre nuestro ambiente.
La parte externa de la atmósfera juega un papel importante en la determinación de las condiciones para la vida en la superficie de la Tierra. La estratósfera protege a la superficie de la intensa radiación y las partículas que bombardean al planeta, por lo que resulta importante descubrir, comprender y controlar las emisiones que contribuyen a esta problemática de la química atmosférica.
La contaminación del aire no es sólo un problema del aire exterior, sino que el aire en recintos cerrados puede contaminarse con humo de cigarro y vapores que se desprenden de ciertos productos, como solventes o limpiadores.
Suscribirse a:
Comentarios (Atom)


